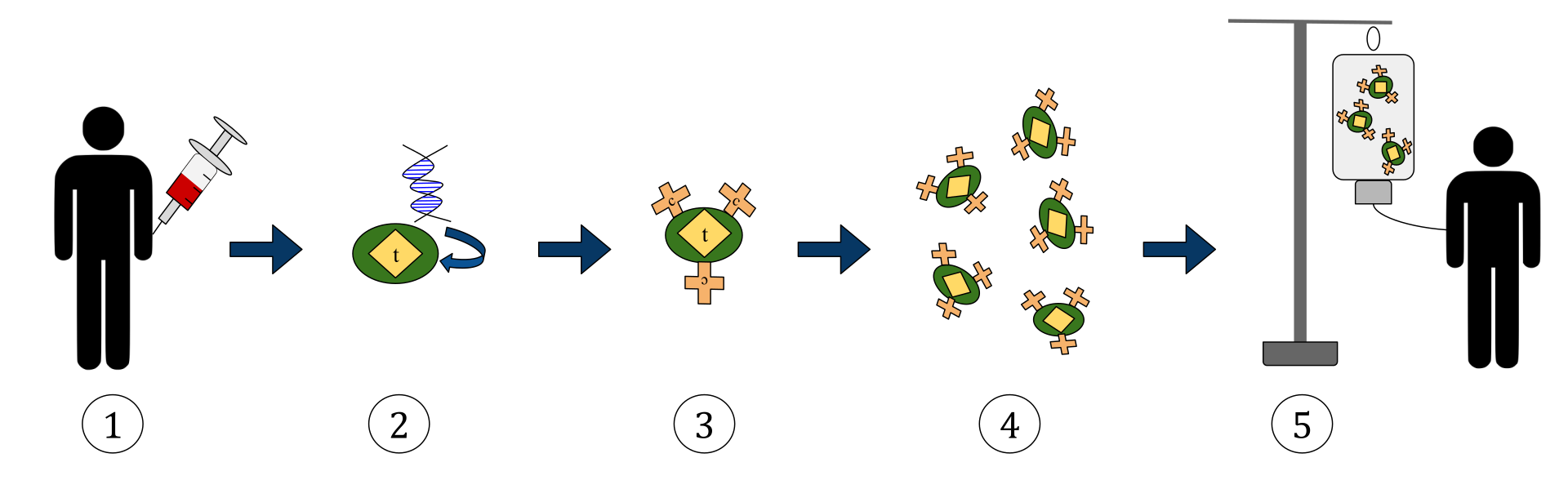
Powyższy diagram przedstawia proces terapii limfocytami T z chimerycznym receptorem antygenu (CAR). Jest to metoda immunoterapii, która jest coraz powszechniejszą praktyką w leczeniu raka. Ostatecznym rezultatem powinna być produkcja wyposażonych komórek T, które potrafią rozpoznawać i zwalczać zakażone komórki rakowe w organizmie.
1. Komórki T (reprezentowane przez obiekty oznaczone jako „t”) są usuwane z krwi pacjenta.
2. Następnie w laboratorium ustawiającym gen, który koduje specyficzne receptory antygenu, zostaje włączony do limfocytów T.
3. Wytwarzanie w ten sposób receptorów CAR (oznaczonych jako c) na powierzchni komórek.
4. Nowo zmodyfikowane komórki T są następnie dalej zbierane i hodowane w laboratorium.
5. Po pewnym czasie zmodyfikowane komórki T są ponownie podawane pacjentowi.
Komórki T chimerycznego receptora antygenu (znany również jako Komórki CAR T.) to komórki T, które zostały genetycznie zmodyfikowane w celu wytworzenia sztucznego receptora komórek T do stosowania w immunoterapii.
Chimeryczne receptory antygenowe (Samochody, znany również jako chimeryczne immunoreceptory, chimeryczne receptory komórek T.lub sztuczne receptory komórek T.) to białka receptorowe, które zostały zaprojektowane tak, aby nadać komórkom T nową zdolność kierowania na określone białko. Receptory są chimeryczne, ponieważ łączą w jednym receptorze zarówno funkcje wiązania antygenu, jak i aktywacji komórek T.
Terapia komórkami CAR-T wykorzystuje komórki T zmodyfikowane przy użyciu CAR do terapii raka. Założeniem immunoterapii CAR-T jest modyfikacja limfocytów T w celu rozpoznawania komórek nowotworowych w celu skuteczniejszego ich namierzania i niszczenia. Naukowcy pobierają komórki T od ludzi, modyfikują je genetycznie, a następnie wlewają powstałe komórki CAR-T pacjentom, aby zaatakować ich guzy. Komórki CAR-T mogą pochodzić z limfocytów T we własnej krwi pacjenta (autologiczne) lub z limfocytów T innego zdrowego dawcy (alogeniczne). Po wyizolowaniu od człowieka te komórki T są poddawane inżynierii genetycznej w celu ekspresji specyficznego CAR, który programuje je tak, aby celowały w antygen obecny na powierzchni guzów. Ze względów bezpieczeństwa komórki CAR-T są zaprojektowane tak, aby były specyficzne dla antygenu eksprymowanego na guzie, który nie jest wyrażany na zdrowych komórkach.
Po podaniu pacjentowi komórek CAR-T działają one jak „żywy lek” przeciwko komórkom rakowym. Kiedy wchodzą w kontakt z docelowym antygenem na komórce, komórki CAR-T wiążą się z nią i ulegają aktywacji, a następnie proliferują i stają się cytotoksyczne. Komórki CAR-T niszczą komórki poprzez kilka mechanizmów, w tym rozległą stymulowaną proliferację komórek, zwiększając stopień, w jakim są toksyczne dla innych żywych komórek (cytotoksyczność) i powodując zwiększone wydzielanie czynników, które mogą wpływać na inne komórki, takie jak cytokiny, interleukiny i czynniki wzrostowe.
Produkcja komórek CAR-T

Pierwszym krokiem w produkcji limfocytów CAR-T jest izolacja limfocytów T z ludzkiej krwi. Limfocyty CAR-T mogą być wytwarzane albo z własnej krwi pacjenta, co jest znane jako leczenie autologiczne, albo z krwi zdrowego dawcy, co jest określane jako leczenie alogeniczne. Proces produkcyjny jest taki sam w obu przypadkach; tylko wybór pierwszego dawcy krwi jest inny.
Najpierw leukocyty są izolowane za pomocą separatora krwinek w procesie znanym jako afereza leukocytów. Komórki jednojądrzaste krwi obwodowej (PBMC) są następnie oddzielane i zbierane. Produkty aferezy leukocytów są następnie przenoszone do centrum przetwarzania komórek. W centrum przetwarzania komórek specyficzne komórki T są stymulowane, aby aktywnie namnażały się i rozwijały do dużej liczby. Aby kierować ich ekspansją, komórki T zazwyczaj traktuje się cytokiną, interleukiną 2 (IL-2) i przeciwciałami anty-CD3.
Rozszerzone limfocyty T są oczyszczane, a następnie transdukowane genem kodującym zmodyfikowany CAR za pośrednictwem wektora retrowirusowego, zazwyczaj wektora integrującego gammaretrowirusa (RV) lub wektora lentiwirusowego (LV). Wektory te są w dzisiejszych czasach bardzo bezpieczne ze względu na częściową delecję regionu U3. Nowe narzędzie do edycji genów CRISPR / Cas9 zostało ostatnio użyte zamiast wektorów retrowirusowych do integracji genu CAR z określonymi miejscami w genomie.
Pacjent przechodzi chemioterapię limfodeplecyjną przed wprowadzeniem zmodyfikowanych komórek CAR-T. Zmniejszenie liczby krążących leukocytów u pacjenta zwiększa liczbę wytwarzanych cytokin i zmniejsza konkurencję o zasoby, co pomaga promować ekspansję zmodyfikowanych komórek CAR-T.
Zastosowania kliniczne
Od marca 2019 r. Na całym świecie prowadzono około 364 trwających badań klinicznych z udziałem limfocytów CAR-T. Większość z tych badań dotyczy raka krwi: terapie CAR-T stanowią ponad połowę wszystkich badań dotyczących nowotworów hematologicznych. CD19 pozostaje najpopularniejszym celem antygenowym, zaraz za nim znajduje się BCMA (powszechnie wyrażany w szpiczaku mnogim). W 2016 roku rozpoczęto badania nad żywotnością innych antygenów, takich jak CD20. Badania dotyczące guzów litych są w mniejszym stopniu zdominowane przez CAR-T, a około połowa badań opartych na terapii komórkowej obejmuje inne platformy, takie jak komórki NK.
Rak
Limfocyty T są genetycznie modyfikowane tak, aby eksprymowały chimeryczne receptory antygenowe, specyficznie skierowane na antygeny na komórkach nowotworowych pacjenta, a następnie podawane pacjentowi, gdzie atakują i zabijają komórki rakowe. Limfocyty T zmodyfikowane CAR można tak zaprojektować, aby celowały w praktycznie każdy antygen związany z nowotworem.
Wczesne badania nad komórkami CAR-T koncentrowały się na nowotworach krwi. Pierwsze zatwierdzone terapie wykorzystują CAR, które są ukierunkowane na antygen CD19, obecny w nowotworach pochodzących z komórek B, takich jak ostra białaczka limfoblastyczna (ALL) i rozlany chłoniak z dużych komórek B (DLBCL). Trwają również prace nad zaprojektowaniem CAR ukierunkowanych na wiele innych antygenów raka krwi, w tym CD30 w opornym chłoniaku Hodgkina; CD33, CD123 i FLT3 w ostrej białaczce szpikowej (AML); i BCMA w szpiczaku mnogim.
Guzy lite stanowią trudniejszy cel. Identyfikacja dobrych antygenów była trudna: takie antygeny muszą wykazywać wysoką ekspresję na większości komórek nowotworowych, ale w większości nie występują w normalnych tkankach. Komórki CAR-T nie są również skutecznie przemieszczane do centrum mas guza litego, a mikrośrodowisko wrogiego guza hamuje aktywność limfocytów T.
Choroby autoimmunologiczne
Podczas gdy większość badań nad komórkami T CAR koncentruje się na tworzeniu komórek T CAR, które mogą wyeliminować określoną populację komórek (na przykład limfocyty T CAR, które celują w komórki chłoniaka), istnieją inne potencjalne zastosowania tej technologii. Limfocyty T mogą również chronić własne antygeny przed reakcjami autoimmunologicznymi. Komórka T regulatorowa wyposażona w CAR może potencjalnie nadawać tolerancję na określony antygen, coś, co można by wykorzystać w przeszczepach narządów lub chorobach reumatycznych, takich jak toczeń.
Satefy
Istnieją poważne skutki uboczne, które wynikają z wprowadzenia komórek CAR-T do organizmu, w tym zespół uwalniania cytokin i toksyczność neurologiczna. Ponieważ jest to stosunkowo nowa terapia, niewiele jest danych na temat długoterminowych skutków terapii komórkami CAR-T. Nadal istnieją obawy dotyczące długoterminowego przeżycia pacjentów, a także powikłań ciąży u pacjentek leczonych limfocytami CAR-T. Spodziewanym efektem ubocznym jest anafilaksja, ponieważ CAR jest wytwarzany z obcym przeciwciałem monoklonalnym, co w rezultacie wywołuje odpowiedź immunologiczną.
Rozpoznanie w miejscu docelowym / poza guzem ma miejsce, gdy komórka CAR-T rozpoznaje prawidłowy antygen, ale antygen ulega ekspresji na zdrowej, niepatogennej tkance. Powoduje to, że komórki CAR-T atakują tkankę nienowotworową, taką jak zdrowe komórki B, które wyrażają CD19. Nasilenie tego niepożądanego efektu może być różne, od aplazji komórek B, którą można leczyć za pomocą wlewów wspomagających, do skrajnej toksyczności prowadzącej do śmierci.
Istnieje również mało prawdopodobne, że zmodyfikowane komórki CAR-T same zostaną przekształcone w komórki rakowe w wyniku mutagenezy insercyjnej, z powodu wektora wirusowego wprowadzającego gen CAR do supresora guza lub onkogenu w genomie komórki T gospodarza. Niektóre wektory retrowirusowe (RV) niosą mniejsze ryzyko niż wektory lentiwirusowe (LV). Jednak oba mają potencjał onkogenny. Przeprowadzono analizę sekwencjonowania genomowego miejsc insercji CAR w limfocytach T w celu lepszego zrozumienia funkcji i trwałości komórek CAR T in vivo.
Zespół uwalniania cytokin
Najczęstszym problemem po leczeniu limfocytami CAR-T jest zespół uwalniania cytokin (CRS), stan, w którym układ odpornościowy jest aktywowany i uwalnia zwiększoną liczbę cytokin zapalnych. Kliniczna manifestacja tego zespołu przypomina posocznicę z wysoką gorączką, zmęczeniem, bólami mięśni, nudnościami, wyciekami z naczyń włosowatych, tachykardią i innymi zaburzeniami czynności serca, niewydolnością wątroby i niewydolnością nerek. CRS występuje u prawie wszystkich pacjentów leczonych terapią CAR-T; w rzeczywistości obecność CRS jest markerem diagnostycznym, który wskazuje, że komórki CAR-T działają zgodnie z zamiarem zabijania komórek rakowych. Należy jednak zauważyć, że wyższy stopień ciężkości CRS nie koreluje ze zwiększoną odpowiedzią na leczenie, ale raczej z większym obciążeniem chorobą.
Neurotoksyczność związana z immunologicznymi komórkami efektorowymi
Toksyczność neurologiczna jest również często związana z leczeniem komórkami CAR-T. Podstawowy mechanizm jest słabo poznany i może, ale nie musi, być związany z CRS. Objawy kliniczne obejmują majaczenie, częściową utratę zdolności spójnego mówienia przy jednoczesnym zachowaniu zdolności do interpretowania języka (afazja ekspresyjna), obniżoną czujność (przeszkadzanie) i drgawki. Podczas niektórych badań klinicznych zdarzały się zgony spowodowane neurotoksycznością. Główną przyczyną śmierci z powodu neurotoksyczności jest obrzęk mózgu. W badaniu przeprowadzonym przez Juno Therapeutics, Inc., pięciu pacjentów włączonych do badania zmarło z powodu obrzęku mózgu. Dwóch pacjentów było leczonych samym cyklofosfamidem, a pozostali trzej byli leczeni kombinacją cyklofosfamidu i fludarabiny. W innym badaniu klinicznym sponsorowanym przez Fred Hutchinson Cancer Research Center odnotowano jeden przypadek nieodwracalnej i śmiertelnej toksyczności neurologicznej 122 dni po podaniu komórek CAR-T.
.













:max_bytes(150000):strip_icc()/GettyImages-103212523-56f2ef855f9b5867a1c90548.jpg)

Discussion about this post