Dziedziczny rak jelita grubego niezwiązany z polipowatością (HNPCC), nazywane również Zespół Lyncha, jest chorobą genetyczną z dominacją autosomalną, która wiąże się z wysokim ryzykiem raka okrężnicy, a także innych nowotworów, w tym raka endometrium (drugi pod względem częstości), jajnika, żołądka, jelita cienkiego, dróg żółciowych, górnych dróg moczowych, mózgu i skóry. Zwiększone ryzyko tych nowotworów wynika z dziedzicznych mutacji, które upośledzają naprawę niedopasowania DNA. Jest to rodzaj zespołu nowotworowego.
Objawy zespołu Lyncha
Ryzyko raka
Ryzyko w ciągu całego życia i średni wiek w chwili rozpoznania raka związanego z zespołem Lyncha
| Rodzaj raka | Ryzyko życiowe (%) | Średni wiek w chwili rozpoznania (lata) |
| Kolorektalna | 52-58 | 44-61 |
| Endometrium | 25-60 | 48-62 |
| Żołądkowy | 6-13 | 56 |
| Jajnik | 4-12 | 42.5 |
Oprócz typów raka przedstawionych na powyższej tabeli, rozumie się, że zespół Lyncha przyczynia się również do zwiększonego ryzyka raka jelita cienkiego, raka trzustki, raka moczowodu / miednicy nerkowej, raka dróg żółciowych, raka mózgu i nowotworów łojowych. Zwiększone ryzyko raka prostaty i raka piersi jest również związane z zespołem Lyncha, chociaż związek ten nie jest do końca zrozumiały.
Dwie trzecie przypadków raka okrężnicy występuje w proksymalnej części okrężnicy, a typowe objawy przedmiotowe i podmiotowe obejmują krew w stolcu, biegunkę lub zaparcie oraz niezamierzoną utratę wagi. Średni wiek rozpoznania raka jelita grubego wynosi 44 lata dla członków rodzin spełniających kryteria amsterdamskie. Średni wiek rozpoznania raka endometrium to około 46 lat. Wśród kobiet z HNPCC, które mają zarówno raka okrężnicy, jak i raka trzonu macicy, około połowa jako pierwsza ma raka endometrium, co sprawia, że rak endometrium jest najczęstszym rakiem wartowniczym w zespole Lyncha. Najczęstszym objawem raka endometrium jest nieprawidłowe krwawienie z pochwy. W HNPCC średni wiek rozpoznania raka żołądka wynosi 56 lat, przy czym najczęściej zgłaszaną patologią jest gruczolakorak jelitowy. W przypadku raka jajnika związanego z HNPCC średni wiek rozpoznania wynosi 42,5 lat; około 30% rozpoznaje się przed 40 rokiem życia.
Stwierdzono znaczną zmienność w częstości występowania raka w zależności od mutacji. Do wieku 75 lat ryzyko raka jelita grubego, raka trzonu macicy, raka jajnika, górnego odcinka przewodu pokarmowego (żołądka, dwunastnicy, dróg żółciowych lub trzustki), raka dróg moczowych, raka prostaty i guzów mózgu było następujące: w przypadku mutacji MLH1 ryzyko było odpowiednio 46%, 43%, 10%, 21%, 8%, 17% i 1%; w przypadku mutacji MSH2 ryzyko wynosiło odpowiednio 57%, 17%, 10%, 25%, 32% i 5%; w przypadku mutacji MSH6 ryzyko wynosiło odpowiednio 15%, 46%, 13%, 7%, 11%, 18% i 1%.
| Gen | Ryzyko raka jajnika | Ryzyko raka endometrium |
|---|---|---|
| MLH1 | 4-24% | 25–60% |
| MSH2 / EPCAM | 4-24% | 25–60% |
| MSH6 | 1–11% | 16–26% |
| PMS2 | 6% (połączone ryzyko) | 15% |
Genetyka

HNPCC jest dziedziczone w sposób autosomalny dominujący. Cechą charakterystyczną HNPCC jest wadliwa naprawa niedopasowania DNA, która powoduje zwiększone tempo zmian pojedynczych nukleotydów i niestabilność mikrosatelitarną, znaną również jako MSI-H (H jest „wysokie”). MSI można zidentyfikować w próbkach raka w laboratorium patologii. W większości przypadków następuje zmiana długości powtórzeń dinukleotydów zasad nukleotydowych cytozyny i adeniny (sekwencja: CACACACACA…).
Cztery główne geny zaangażowane w HNPCC normalnie kodują białka, które tworzą dimery, aby funkcjonować:
- Białko MLH1 dimeryzuje z białkiem PMS2, tworząc MutLα, które koordynuje wiązanie innych białek zaangażowanych w naprawę niedopasowań, takich jak helikaza DNA, białko wiążące jednoniciowe DNA (RPA) i polimerazy DNA.
- Białko MSH2 dimeryzuje z białkiem MSH6, które identyfikuje niedopasowania za pomocą modelu przesuwnej klamry, białka do skanowania w poszukiwaniu błędów.
Upośledzenie któregokolwiek z genów dimeru białka upośledza funkcję białka. Te 4 geny biorą udział w korekcji błędów (naprawie niedopasowania), więc dysfunkcja genów może prowadzić do niemożności naprawienia błędów replikacji DNA i wywołania HNPCC. Wiadomo, że HNPCC jest powiązany z innymi mutacjami w genach zaangażowanych w szlak naprawy niedopasowania DNA:
| Nazwa OMIM | Geny zaangażowane w HNPCC | Częstość mutacji w rodzinach HNPCC | Umiejscowienie | Pierwsza publikacja |
|---|---|---|---|---|
| HNPCC1 (120435) | MSH2 / EPCAM | około 60% | 2p22 | Fishel 1993 |
| HNPCC2 (609310) | MLH1 | około 30% | 3p21 | Papadopoulos 1994 |
| HNPCC5 | MSH6 | 7–10% | 2p16 | Miyaki 1997 |
| HNPCC4 | PMS2 | stosunkowo rzadkie | 7p22 | Nicolaides 1994 |
| HNPCC3 | PMS1 | opis przypadku | 2q31-q33 | Nicolaides 1994 |
| HNPCC6 | TGFBR2 | opis przypadku | 3p22 | |
| HNPCC7 | MLH3 | sporne | 14q24.3 |
Większość osób z HNPCC dziedziczy stan po rodzicu. Jednak ze względu na niepełną penetrację, zmienny wiek rozpoznania raka, zmniejszenie ryzyka raka lub przedwczesną śmierć, nie wszystkie osoby z mutacją genu HNPCC mają rodzica, który miał raka. Niektórzy ludzie rozwijają HNPCC de novo w nowym pokoleniu, bez dziedziczenia genu. Osoby te są często identyfikowane dopiero po wystąpieniu wczesnego raka okrężnicy. Rodzice z HNPCC mają 50% szans na przekazanie mutacji genetycznej każdemu dziecku. Należy również zauważyć, że szkodliwa mutacja w jednym z genów MMR nie jest wystarczająca do wywołania raka, ale raczej muszą wystąpić dalsze mutacje w innych genach supresorowych.
Diagnoza zespołu Lyncha
Diagnoza zespołu Lyncha jest stosowana u osób z mutacją DNA linii zarodkowej w jednym z genów MMR (MLH1, MSH2, MSH6 i PMS2) lub genie EPCAM, zidentyfikowane na podstawie testów genetycznych. Kandydatów do testów genetycznych linii germinalnej można zidentyfikować na podstawie kryteriów klinicznych, takich jak Amsterdam Clinical Criteria i Bethesda Guidelines, lub poprzez analizę nowotworu metodą immunohistochemii (IHC) lub test niestabilności mikrosatelitarnej (MSI). W USA stowarzyszenia zawodowe zalecają badanie każdego raka okrężnicy pod kątem MSI lub IHC jako badanie przesiewowe w kierunku zespołu Lyncha, ale nie zawsze jest to wykonywane ze względu na ograniczenia kosztów i zasobów. Testy genetyczne są dostępne w handlu i obejmują badanie krwi.
Immunohistochemia
Immunohistochemia (IHC) to metoda, którą można stosować do wykrywania nieprawidłowej ekspresji białka naprawy niedopasowania (MMR) w guzach związanych z zespołem Lyncha. Chociaż nie jest to diagnostyka zespołu Lyncha, może odgrywać rolę w identyfikacji osób, które powinny mieć testy linii germinalnej. Dwie metody wdrażania testów IHC obejmują testy oparte na wieku i testy uniwersalne dla wszystkich ludzi. Obecnie nie ma powszechnej zgody co do tego, jaką metodę przesiewową należy zastosować. Oparte na wieku testy IHC zostały zasugerowane częściowo ze względu na analizy kosztów i korzyści, podczas gdy uniwersalne testy dla wszystkich osób z rakiem jelita grubego zapewniają, że osoby z zespołem Lyncha nie zostaną pominięte. Aby uwzględnić koszty, naukowcy próbują przewidzieć MSI lub IHC bezpośrednio na podstawie sposobu, w jaki guz wygląda pod mikroskopem, bez przeprowadzania jakichkolwiek testów molekularnych.
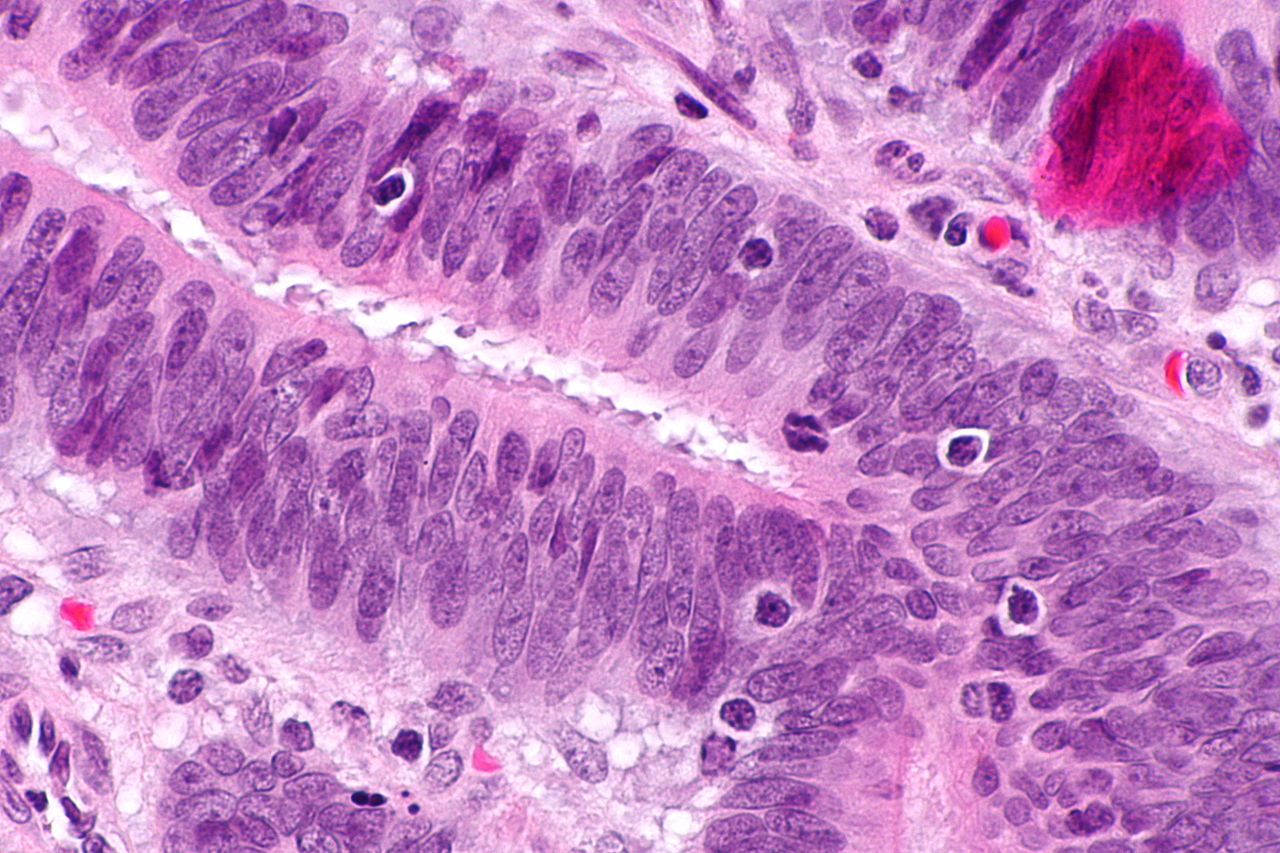
Niestabilność mikrosatelity
Mutacje w systemach naprawy niedopasowania DNA mogą prowadzić do trudności w przekazywaniu regionów w DNA, które zawierają powtarzające się wzory dwóch lub trzech nukleotydów (mikrosatelity), zwane inaczej niestabilnością mikrosatelitarną (MSI). MSI jest identyfikowane poprzez ekstrakcję DNA zarówno z próbki tkanki guza, jak i próbki normalnej tkanki, a następnie analizę PCR regionów mikrosatelitarnych. Analiza MSI może posłużyć do identyfikacji osób, które mogą mieć zespół Lyncha i skierowania ich do dalszych badań.
Klasyfikacja
Trzy główne grupy nowotworów MSI-H (niestabilność mikrosatelitarna – MSI) można rozpoznać na podstawie kryteriów histopatologicznych:
- nowotwory prawostronne słabo zróżnicowane
- raki śluzowe prawostronne
- gruczolakoraki w dowolnej lokalizacji wykazujące mierzalny poziom limfocytów śródnabłonkowych (TIL)
Kryteria histopatologiczne nie są wystarczająco czułe, aby wykryć MSI na podstawie histologii, ale naukowcy próbują wykorzystać sztuczną inteligencję do przewidywania MSI na podstawie histologii.
Ponadto HNPCC można podzielić na zespół Lyncha I (rodzinny rak okrężnicy) i zespół Lyncha II (HNPCC związany z innymi nowotworami przewodu pokarmowego lub układu rozrodczego).
Zapobieganie
Badanie przesiewowe
Poradnictwo genetyczne i testy genetyczne są zalecane dla rodzin, które spełniają kryteria amsterdamskie, najlepiej przed zachorowaniem na raka okrężnicy.
Rak okrężnicy
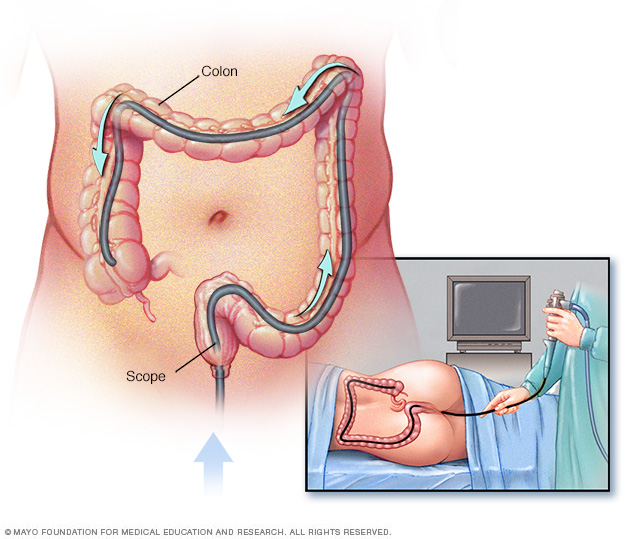
Kolonoskopie są zalecane jako profilaktyczna metoda nadzoru osób z zespołem Lyncha lub genami związanymi z LS. W szczególności zaleca się rozpoczynanie kolonoskopii w wieku 20–25 lat w przypadku nosicieli mutacji MLH1 i MSH2 oraz 35 lat w przypadku nosicieli mutacji MSH6 i PMS2. W przypadku pacjentów z zespołem Lyncha należy następnie przeprowadzać obserwację kolonoskopową w odstępach 1-2 lat.
Rak endometrium / jajnika
Zaleca się coroczne badanie USG przezpochwowe z biopsją endometrium lub bez niej w przypadku przesiewowych badań przesiewowych w kierunku raka jajnika i endometrium. W przypadku kobiet z zespołem Lyncha coroczne badanie krwi CA-125 można wykorzystać do badania przesiewowego w kierunku raka jajnika, jednak dane dotyczące skuteczności tego testu w zmniejszaniu śmiertelności są ograniczone.
Inne nowotwory
Istnieją również strategie wczesnego wykrywania innych nowotworów lub zmniejszania szans na ich rozwój, o których osoby z zespołem Lyncha mogą porozmawiać ze swoim lekarzem, jednak ich skuteczność nie jest jasna. Te opcje obejmują:
- Endoskopia górna w celu wykrycia raka żołądka i jelita cienkiego co 3-5 lat, zaczynając najwcześniej w wieku 30 lat (najlepiej w warunkach badawczych)
- Coroczne badanie moczu w celu wykrycia raka pęcherza moczowego, rozpoczynając najwcześniej w wieku 30 lat (najlepiej w warunkach badawczych)
- Coroczne badania fizykalne i neurologiczne w celu wykrycia raka w ośrodkowym układzie nerwowym (mózgu lub rdzeniu kręgowym), rozpoczynając najwcześniej w wieku 25 lat
Kryteria amsterdamskie
Poniżej przedstawiono kryteria amsterdamskie przy identyfikowaniu kandydatów wysokiego ryzyka do molekularnych testów genetycznych:
Kryteria Amsterdam I (wszystkie podpunkty muszą być spełnione):
- Trzech lub więcej członków rodziny z potwierdzonym rozpoznaniem raka jelita grubego, z których jeden jest krewnym pierwszego stopnia (rodzic, dziecko, rodzeństwo) pozostałych dwóch
- Dwa kolejne pokolenia dotknięte chorobą
- Jeden lub więcej raków okrężnicy zdiagnozowanych w wieku poniżej 50 lat
- Wykluczono rodzinną polipowatość gruczolakowatą (FAP)
Kryteria Amsterdam II zostały opracowane w 1999 roku i poprawiły czułość diagnostyczną zespołu Lyncha poprzez uwzględnienie raka endometrium, jelita cienkiego, moczowodu i miedniczki nerkowej.
Amsterdam Criteria II (wszystkie podpunkty muszą być spełnione):
- Trzech lub więcej członków rodziny z nowotworami związanymi z HNPCC, z których jeden jest krewnym pierwszego stopnia dwóch pozostałych
- Dwa kolejne pokolenia dotknięte chorobą
- Jeden lub więcej nowotworów związanych z HNPCC zdiagnozowanych w wieku poniżej 50 lat
- Wykluczono rodzinną polipowatość gruczolakowatą (FAP)
Operacja
Profilaktyczną histerektomię i salpingooforektomię (usunięcie macicy, jajowodów i jajników w celu zapobieżenia rozwojowi raka) można wykonać przed rozwojem raka jajnika lub endometrium.
Leczenie zespołu Lyncha
Chirurgia pozostaje pierwszą linią leczenia HNPCC. Pacjenci z zespołem Lyncha, u których rozwinie się rak jelita grubego, mogą być leczeni częściową kolektomią lub całkowitą kolektomią z zespoleniem krętniczo-odbytniczym. Ze względu na zwiększone ryzyko raka jelita grubego po częściowej kolektomii i podobną jakość życia po obu operacjach, preferowaną metodą leczenia HNPCC może być całkowita kolektomia, zwłaszcza u młodszych pacjentów.
Trwają kontrowersje co do korzyści z terapii adiuwantowych opartych na 5-fluorouracylu w leczeniu nowotworów jelita grubego związanych z HNPCC, zwłaszcza w stadium I i II.
- Terapia przeciwciałami anty-PD-1 może być skuteczna.
Blokada punktów kontrolnych z terapią anty-PD-1 jest obecnie preferowaną terapią pierwszego rzutu w przypadku zaawansowanego raka jelita grubego o wysokim stopniu niestabilności mikrosatelitarnej.
.
















:max_bytes(150000):strip_icc()/woman-giving-herself-insulin-shot-injection--628470588-5c796ede882d47058f28f0779e5ce72a.jpg)

Discussion about this post